研究活動
AIMの腎臓結石に対する予防・治療効果についての論文が、英科学誌「Communications Biology」に発表されました
2022.08.04
プレスリリース
AIMの腎臓結石に対する予防・治療効果についての論文、"Two independent modes of kidney stone suppression achieved by AIM/CD5L and KIM-1" が、英科学誌「Communications Biology」に発表されました。
腎臓結石に対するAIM並びにKIM-1の予防治療効果の発見
発表者
宮﨑 徹(一般社団法人AIM医学研究所(IAM)代表理事・所長)
新井 郷子(東京大学大学院医学系研究科 准教授/一般社団法人AIM医学研究所(IAM))
前原 奈都美(一般社団法人AIM医学研究所(IAM)シニア・リサーチフェロー)
松浦 恭平(東京大学大学院医学系研究科・現Beyond Next Ventures株式会社)
発表の概要
腎臓結石は、あらゆる疾患の中で最も患者数が多い疾患の一つであるが、生活習慣・食習慣の近代化に伴いその患者数は増加しており、さらに外科的に結石を除去した後も50%以上の患者で複数回再発する。腎臓結石の約8割がシュウ酸カルシウム結石であり、1割弱が尿酸結石である。腎臓結石に対する治療法としては、発生した結石を外科的に破壊したり摘除する以外には、結石が発生しにくくなるような食事のコントロールしかなく、結石の発生や再発を抑制したり、発生した結石を除去する内科的な治療法・薬剤はほとんどないと言ってよい。
今回、一般社団法人AIM 医学研究所(IAM)の宮﨑徹所長らのグループは、シュウ酸カルシウムの結晶を試験管内で成長させる実験や、腎臓結石を発生させたマウスを用いた研究により、①AIMがシュウ酸カルシウム結晶に結合し、その成長を阻害すること、②AIMを1日1回経静脈的に投与することによって、腎臓結石の発生が顕著に抑制されること、③こうした腎臓結石の抑制は、AIMの一部分のペプチドを投与することでも達成できること、④投与したAIMが、炎症を引き起こすdamage associated molecular patterns(DAMPs:注1)の除去を通じて尿細管の炎症を抑制することによって、全身状態を改善すること、⑤近位尿細管上皮細胞に発現するKIM-1分子が、すでに発生した結石の、上皮細胞による貪食を誘導することによって、腎臓から結石を減らす作用があること、を明らかにした。
これらの発見により、今まで効果的な内科的治療法や薬剤がほぼなかった腎臓結石に対し、AIMやKIM-1が新しい予防・治療法となることが期待される。また、腎臓結石は再発率が高いが、AIMが効果的な再発予防薬となる可能性も示唆される。また、アラニン:グリオキシル酸アミノトランスフェラーゼが欠損する常染色体劣性遺伝病である原発性高シュウ酸尿症Ⅰ型では、様々な臓器にシュウ酸カルシウム結晶が蓄積し腎臓では結石が多発するが、このような疾患に対する効果的な治療法として応用できる可能性も期待できる。
こうしたAIMやKIM-1による新しい内科的治療法が開発されると、患者数が非常に多い腎臓結石に対する外科的治療による医療財政への負担を軽減させ得ることも期待され、社会的なインパクトは大きいと考えられる。
なお、本研究は、国立研究開発法人日本医療研究開発機構革新的先端研究開発支援事業 インキュベートタイプ(LEAP)の一環として行われた。本研究成果は、2022年8月3日(米国東部時間)に「Communications Biology」オンライン版で公開される。
詳細な発表内容
AIMによる体内のゴミ掃除機構と疾患抑制
IAMの宮﨑徹所長らのグループが発見した血中タンパク質AIMは、おもにマクロファージが体内で産生する血中タンパク質であり、これまで宮﨑所長のグループを中心に、腎疾患、脳梗塞、脂肪肝、肝臓癌、肥満、真菌性腹膜炎、多発性硬化症など様々な疾患に対し抑制的な効果をもち、幅広い疾患に対する新規治療剤となる可能性を、主に動物実験で明らかにしている(文献1-9)。また、健康時には、AIMはIgM五量体と結合し不活性型として、高い濃度(ヒトで5μg/mL程度)で血液中にストックされており、疾患発症に伴いIgM(注2)から解離し、活性型のAIMとして疾患治癒を促進することが知られている(文献10)。AIMの量や活性化が不足していると、様々な疾患の発症・増悪を惹起するが、最も顕著に影響を受けるのは腎疾患である。実際、猫のAIMはIgMとの結合親和性が異常に高いため、疾患時にAIMがIgMから解離せず活性化しないため、ほとんどの猫で慢性腎臓病が発症し、多くが腎不全で死亡してしまう(文献11)。
AIMによる腎臓結石発症抑制のメカニズム
AIMは3つのSRCRドメインを持ち、2番目のドメイン内にあるフリーのシステイン残基と、3つ目のドメインに存在する正に荷電した表面アミノ酸のクラスターの2ヵ所を通じて、細胞の死骸、変性したタンパク質、炎症を引き起こすDAMPsなど、体から出る様々な「ゴミ」と結合する一方、表面が強く負に荷電しているN末端のドメインが、貪食細胞上のスカベンジャー受容体に認識され、結合したゴミと一緒に貪食されてしまう(図1)。
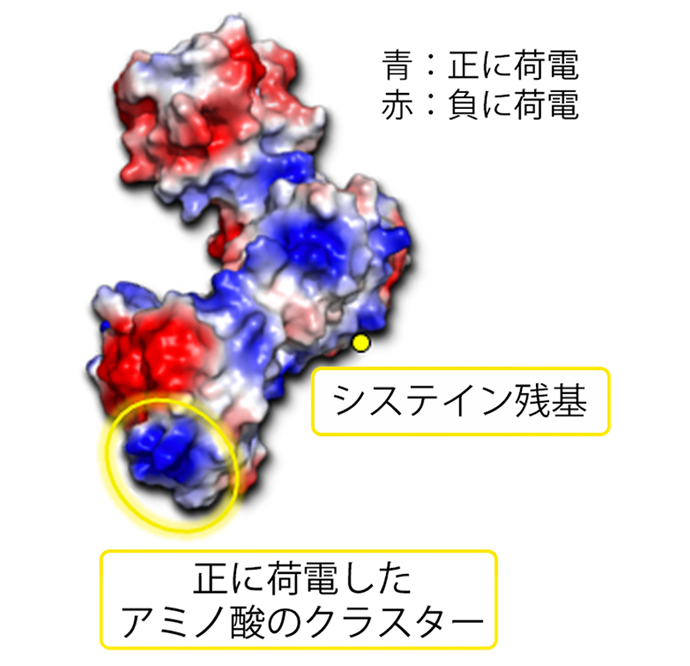
図1:AIMの立体構造モデル
結果的に、AIMは様々なゴミを体内から効率よく除去(掃除)させる。こうしたゴミが体内に蓄積すると、腎臓病をはじめ様々な疾患が発症・増悪するので、AIMはゴミ掃除を通じ、多くの疾患の予防・治療に貢献している(文献12)。
腎臓結石の8割以上で、シュウ酸カルシウムの結晶が核となり、多くのタンパク質を巻き込みながら大きな結石へと成長する。したがって、シュウ酸カルシウムの結晶も、「ゴミ」の一種であり、そのほかの疾患と同じように、AIMによって掃除され疾患が抑制されることになる。しかし興味深いことに、腎臓結石の場合、その「ゴミ掃除」の機構が他の疾患とは異なっていた。
シュウ酸カルシウム結晶との結合は、AIMのN末端ドメインとシュウ酸カルシウム結晶との電荷的相互作用を通じてなされていた。その結果、シュウ酸カルシウム結晶表面の電荷は奪われ、結晶どうしが重合できず、結晶は成長しなくなることが明らかとなった。実際、試験管内でシュウ酸カルシウム溶液にAIMを添加すると、一定時間後に観察される刺々しい形をした大きな結晶の産生が顕著に抑制された(図2)。
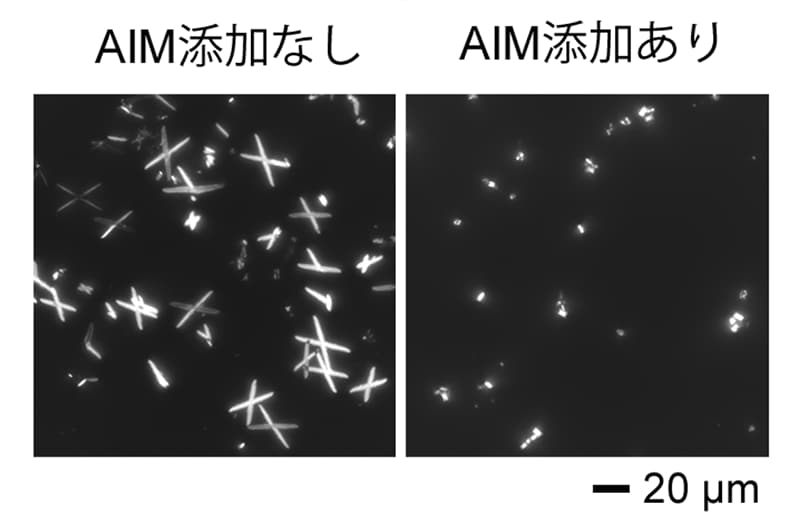
図2:AIM添加による
シュウ酸カルシウム結晶の成長抑制
また、マウスの腹腔内にグリオキシル酸を負荷すると、腎臓にシュウ酸カルシウム結石を発生させることできるが、同時にAIM(100μg)を一日一回投与すると、腎臓結石の発生は著しく抑制された(図3)。シュウ酸カルシウムと結合するAIMのN末端ドメインのみ(100アミノ酸程度)を用いても、同様の結晶の成長抑制、並びに腎臓結石発生の抑制を観察した。
AIMのN末端ドメインと同じように、強く負に荷電しているタンパク質や化学化合物あるいは人工的なペプチドも、マウスに投与すると腎臓結石の発生を抑制したが、AIMと比べ、結石発生の抑制効果は低かった。これは、AIMとシュウ酸カルシウムとの結合が、他に比べ顕著に強いことが理由であることも分かった。
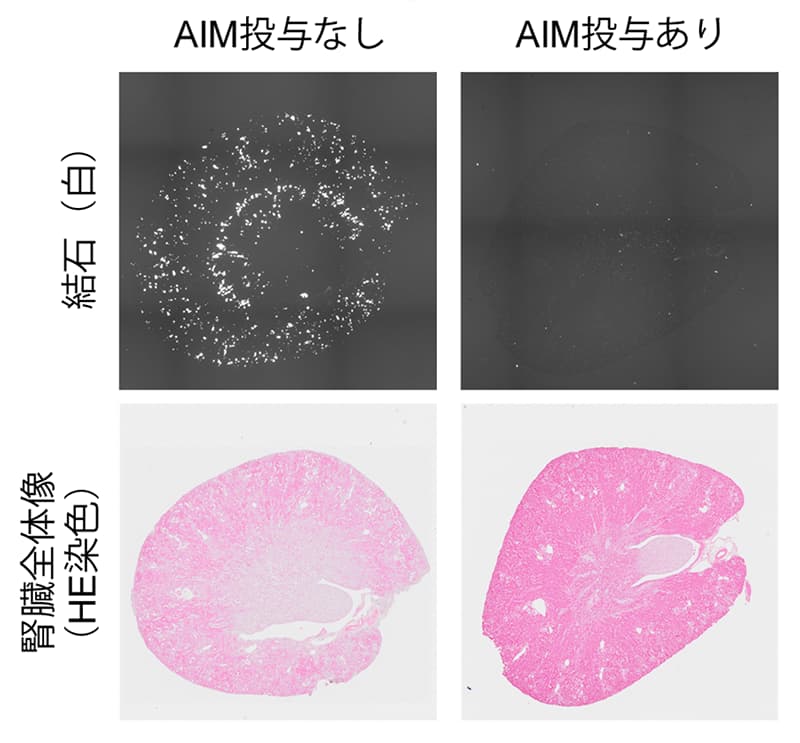
図3:AIM投与による腎臓結石の抑制
さらに、マウスにグリオキシル酸を投与し腎臓にシュウ酸カルシウム結晶が沈着すると、その刺々しい形状によって腎臓の細胞が傷つけられ、障害を受けた細胞からDAMPsが放出されて慢性的な炎症が生じ、全身状態も悪化する。しかしAIMを投与すると、結晶の成長を抑制すると同時に、DAMPsも除去されるので、炎症は抑制され全身状態も改善する。このような効果は、DAMPsに結合し除去することができるAIMに特異的であり、他のタンパク質、科学化合物、ペプチドの投与では認められない。
このように、AIMの投与は腎臓結石の発生を抑制し、シュウ酸カルシウム結晶の沈着に伴う腎臓での炎症とそれによる全身状態の悪化を改善する。したがって、腎臓結石の予防や結石除去後の再発の抑制に効果的であると考えられる。
KIM-1による結石除去機構
一方で、すでに発生した結石をAIMで効果的に除去することはできなかったが、尿細管上皮細胞に特異的に発現するkidney injury molecule 1(KIM-1;注3)が、上皮細胞による結石の貪食を誘導し、腎臓から結石を減らす作用があることを見出した。マウスにグリオキシル酸を投与し、腎臓に結石が蓄積するにしたがって腎臓におけるKIM-1の発現は上昇するが、結石量がピークとなる6日目以降、結石の量は減り始める。しかし、KIM-1を欠損するマウスにグリオキシル酸を投与すると、6日目以降も結石の量は減らず増加した。この結果から、KIM-1の発現を増強することによって、すでに発生した結石を外科的な侵襲なしに腎臓から除去できる可能性が示唆された。急性腎障害においては、AIMとKIM-1は共同して尿細管中の死細胞デブリを除去し、疾患治癒に貢献するが、腎臓結石では独立して働き、AIMが結石発生を阻止し、KIM-1が既に発生した結石の除去を誘導する、という興味深い機構が明らかになった。
文献
- Miyazaki, T. et al. J. Exp. Med. 189: 413-422 (1999).
- Kurokawa, J. et al. Cell Metab. 11: 479-492 (2010).
- Arai, S. et al. Cell Rep. 3: 1187-1198 (2013).
- Maehara, N., et al. Cell Rep. 9: 61-74 (2014).
- Hamada, N. ey al. Nat. Commun. 5: 3147 (2014).
- Wang, C. et al. Cell. 163: 1413-1427 (2015).
- Arai, S. et al. Nat. Med. 22: 183-193 (2016).
- Tomita, T. et al. Sci. Rep. 25: 6450 (2017).
- Maehara, N. et al. Cell Rep. 36: 109693 (2021).
- Hiramoto, E. et al. Sci. Adv. 4: eaau1199 (2018).
- Sugisawa, R. et al. Sci. Rep. 6: 35251 (2016).
- Arai, S. & Miyazaki, T. Semin. Immunopathol. 40: 567-575 (2018).
発表雑誌
雑誌名:Communications Biologyオンライン版
論文タイトル:Two independent modes of kidney stone suppression achieved by AIM/CD5L and KIM-1
DOI:10.1038/s42003-022-03750-w
著者:Kyohei Matsuura1, Natsumi Maehara1, 2, Ayaka Eguchi1, Aika Hirota1, 2, Keisuke Yasuda1, 2, Kaori Taniguchi1, Akemi Nishijima1,2, Nobuyuki Matsuhashi3, Yoshiyuki Shiga3, Yasuhiro Iguchi4, Kazunari Tanabe5, Satoko Arai1, 2 & Toru Miyazaki2
所属:1.東京大学、2.AIM医学研究所(IAM)、3.NTT東日本関東病院、4.井口泌尿器科病院、5.東京女子医科大学
研究に関するお問い合わせ
一般社団法人AIM医学研究所
代表理事・所長 宮﨑 徹(みやざき とおる)
TEL:
FAX:
E-mail:
用語解説
(注1)Apoptosis Inhibitor of Macrophage(AIM):マクロファージから分泌され、当初細胞のアポトーシス(細胞死)を抑制する分子として宮﨑徹博士が発見したもの。その後の研究で、体内で発生する様々な不要物(ゴミ)と結合し、貪食細胞に除去させることで、様々な疾患を抑制・治癒する作用があることが明らかになった。遺伝子名CD5L。
(注2)Damage Associated Molecular Patterns(DAMPs):損傷組織または壊死に向かっている細胞から放出される分子構造(微粒子)で、自然免疫、獲得免疫、また炎症反応の誘導に関与する。脳梗塞の増悪に関与する主なDAMPsとして、PRDX1(Peroxiredoxin-1)、HMGB1(high mobility group box 1)、S100A(S100-Calcium-Binding Protein A)などが知られている。
(注3)IgM:免疫グロブリンM。IgGやIgAなどと共に血中に存在する抗体の一種であり、抗体産生過程の最も初期に現れる抗体である。血中濃度は100~150 mg/dL。
(注4)Kidney Injury Molecule 1(KIM-1):腎障害時に腎臓の近位尿細管上皮細胞で強い発現が誘導される膜タンパク質。スカベンジャー受容体としての機能を持ち、急性腎障害時に尿細管中の細胞の死骸(デブリ)などに付着したAIMと結合し、上皮細胞によるデブリの貪食除去を誘導する。また、尿中に放出されるKIM-1の断片が、急性腎障害のバイオマーカーとして使われることもある。
